كيف تشغل الذرة معظم حجم الذرة في النواة؟ الذرة هي أساس كل عنصر في الجدول الدوري، وهي أساس كل مادة في الطبيعة من حولنا، والمادة عنصر أو أكثر.
يوجد فرق بين العناصر وبعضها لأن كل عنصر له ذرات لها بنية فريدة تختلف عن ذرات العناصر الأخرى وتتكون الذرة من عدة مكونات أولها النواة ثم النيوترونات والبروتونات والإلكترونات.
جدول المحتويات
ما الذي يشغل معظم حجم الذرة؟

- تمثل الذرة لبنة البناء الأساسية لبناء وتشكيل بنية كل مادة من حولنا في الكون، وتحدد بنية الذرات الخصائص الكيميائية والفيزيائية للمادة، والذرة عبارة عن نواة موجبة الشحنة محاطة بشكل سلبي. المشحونة هي الإلكترونات.
- أهم الأشياء في النواة كما قلنا هي البروتونات التي لها شحنة موجبة والنيوترونات التي لها شحنة متعادلة وليست موجبة أو سالبة فقط.
- تدور الإلكترونات حول النواة في العديد من المدارات بأنصاف أقطار مختلفة، وتُعرف مجموعة الإلكترونات العديدة باسم “سحابة الإلكترون”. تحتل هذه الإلكترونات، أو سحابة الإلكترون عمومًا، معظم المساحة التي تشغلها الذرة.
- لا يمكننا أيضًا تحديد المساحة التي يشغلها الإلكترون، ولكن من المتوقع أن يكون الحجم الذي يشغله الإلكترون في الذرة حوالي 95:99 حجم الذرة.
انظر أيضا: ما هي الذرة المخفوقة؟
مكونات الذرة

هناك عدة أجزاء مكونة للذرة وهي أساس كل الذرات، وسنذكرها معكم على النحو التالي:
نواة الذرة
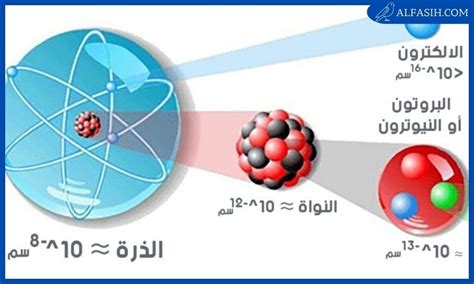
- النواة داخل الذرة لأنها تحتوي على معظم كتلة الذرة وداخل النواة عبارة عن نيوترونات وبروتونات وكلاهما يسمى “نيوكليونات” والإلكترونات أخف من النيوترونات والبروتونات. وهي تدور حول النواة أو الكتلة أو عدد النواة.
البروتونات

- في اللغة الأجنبية، تعني “البروتونات” وهي أساس الذرات، لأن الذرة يمكن أن تأخذ وتتخلى عن النيوترونات والإلكترونات، ويُشار إلى عدد البروتونات بالحرف “Z” وهذا الرقم يمثل هوية ذرة.
- ويسمى أيضًا “العدد الذري” والذي يعني “العدد الذري” باللغة الإنجليزية ومن المعروف أن البروتون له شحنة موجبة وكتلة 1.673 * 10 ^ -27.
- يتم ترتيب العناصر في الجدول الدوري وفقًا لعددها الذري المتزايد ويتكون البروتون من 3 كواركات، وكواركان علويان يحملان شحنة موجبة وكوارك قاع يحمل شحنة سالبة.
النيوترونات

- تسمى النيوترونات باللغة الإنجليزية “نيوترونات”، ويُشار إلى الذرة بالحرف “N”، وعدد كتلة الذرة هو مجموع البروتونات والنيوترونات “Z + N” والقوة الشديدة للنواة تربط البروتونات والنيوترونات معًا لتكوين نواة ذرة، والنيوترون له شحنة متعادلة، أي أنه ليس له شحنة، علاوة على أنه لا ينجذب إلى الإلكترونات أو البروتونات.
- تبلغ كتلة النيوترون حوالي 1.6749 * 10 ^ -27 كيلوجرامًا، وتتكون، مثل البروتون، من 3 كواركات، اثنان منها عبارة عن كواركات سفلية، يحمل كل منها شحنة سالبة، وكوارك علوي آخر يحمل شحنة موجبة.
الإلكترونات

- ومعناها في اللغة الإنجليزية هو “الإلكترونات” وهي أصغر بكثير من النيوترونات وأيضًا البروتونات وهي تدور حول نواة الذرة في مدارات مختلفة كما أنها تنجذب أيضًا إلى البروتونات في النواة التي تحمل الشحنة السالبة، و شحنتها تساوي قيمة شحنة البروتون، لكن علامتها مختلفة لأن شحنة البروتونات موجبة.
انظر أيضًا: بنية الذرة وتاريخها وأصولها
جبن

- في الواقع، يُعتقد حاليًا أن الكواركات هي أبسط مكونات المادة والكواركات هي الجسيمات الأولية دون الذرية.
- هناك ستة أنواع تختلف باختلاف شحنتها وكتلتها، وهي السفلي والعلوي.
- ترتبط الحضيض الشمسي والقمة والجاذبية والغريب والكواركات معًا لتشكيل النيوترونات والبروتونات.
- لا تمتلك الكواركات هيكلًا واضحًا ولا يمكننا تقسيمها إلى شيء أبسط.
- عادة ما تتحد مع كواركات أخرى أو كواركات مضادة لتكوين جميع الهادرونات، بما في ذلك الباريونات والميزونات، وتتكون الباريونات من 3 كواركات، وأشهرها النيوترونات والبروتونات.
معلومات الإلكترون

- تبلغ كتلة الإلكترونات حوالي 9.109 * 10 ^ -31 كيلوغرامًا وتدور حول النواة في مدارات نصف دائرية، على غرار مدارات الكواكب.
- إنهم يدورون حول النجوم، لكن السلوك الفعلي للإلكترونات أكثر تعقيدًا.
- يتم تنظيم الإلكترونات إلى حد كبير في أغلفة تسمى “أصداف” باللغة الإنجليزية، وهي تمثل المناطق التي توجد فيها الإلكترونات.
- أغلفة الإلكترونات، بعضها يشبه شكل الكرة وبعضها يشبه شكل الأجراس والأشكال الأخرى.
- ويمكننا إيجاد الإلكترونات في أي مكان في الذرة، وقد اكتشف طومسون الإلكترون في عام 1897.
- كان هذا الاكتشاف مثيرًا للجدل في البداية، ولكن تم قبول اكتشافاته تدريجياً من قبل العلماء.
- أجرى طومسون تجاربه باستخدام أنابيب أشعة الكاثود، والتي أصبحت جزيئاتها تُعرف بالإلكترونات.
معلومات عامة عن مكونات الذرة

- البروتونات والنيوترونات لها نفس الحجم تقريبًا، وهو أكبر بكثير من حجم الإلكترون.
- كتلة البروتون تبلغ 1840 ضعف كتلة الإلكترون.
- تحتوي النواة على نيوترون وبروتون وهي موجبة الشحنة.
- الذرة صغيرة جدًا بمتوسط حجم 100 ميكرون.
- تعني كلمة nucleus باللغة الإنجليزية “nucleus” وتشكل معظم كتلة الذرة، لكن الإلكترونات تشكل معظم حجم النواة.
- تنتج النظائر المختلفة للعنصر، والتي تعني “النظائر” باللغة الألمانية، من الأعداد المختلفة للنيوترونات.
- بينما الأيونات، والتي تعني “الأيونات” في اللغة الإنجليزية، تنتج من الاختلاف في عدد الإلكترونات.
- كما أنها تمثل الذرة المشحونة كهربائيًا، وتمثل الأيونات والنظائر في ذرة ذات عدد ثابت من البروتونات الأشكال المختلفة لعنصر كيميائي واحد.
- إن إزالة أو إضافة إلكترون من ذرة أسهل بكثير من إزالة الإلكترونات أو البروتونات.
- يشمل التفاعل الذرات أو مجموعات الذرات والتفاعل بين الإلكترونات.
- تحتوي الذرات دائمًا على نفس عدد الإلكترونات والبروتونات.
- تم اكتشاف النواة من قبل الفيزيائي رذرفورد في عام 1911.
- أعطى هذا اسم البروتونات للجسيمات التي تحمل شحنة ذرية موجبة.
- أعلن رذرفورد أيضًا عن وجود ما يسمى بالجسيمات المحايدة في النواة.
- وفي عام 1932، حدد جيمس تشادويك هذه الجسيمات المحايدة.
قد يثير هذا اهتمامك: استكشاف بنية الذرة وموقع كل جسيم فيها
تشكيل الذرة

- مصطلح الذرة يأتي من اليونانية ويعني غير قابل للتجزئة.
- لأنه في ذلك الوقت ساد الاعتقاد بأنه لا يوجد شيء أصغر في الكون من الذرة وأن الذرة لا يمكن تقسيمها إلى أجزاء أبسط.
- حاليًا، تمكن العلماء من اكتشاف المكونات الرئيسية للذرة.
- هي بروتونات وإلكترونات ونيوترونات مكونة من جسيمات أصغر منها، وتسمى كواركات، وتعني “كواركات” بالإنجليزية.
- بعد الانفجار العظيم قبل حوالي 13.7 مليار سنة، تشكلت الذرات وانخفضت درجة حرارة الكون.
- وكانت هناك ظروف مواتية لتكوين الكواركات والإلكترونات.
- تشكل الكواركات معًا البروتونات والنيوترونات، وهم بدورهم يشكلون نواة الذرة، وهذا ما حدث في الدقائق الأولى من وجود الكون.
- استغرق الكون وقتًا طويلاً جدًا، 380 ألف سنة، ليبرد بدرجة كافية.
- لإبطاء سرعة الإلكترونات، يمكن للنواة أن تلتقطها لتكون أول ذرة في الكون.
- كانت ذرات الهيدروجين والهيليوم أولى هذه الذرات، وما زالت هذه العناصر حتى يومنا هذا هي الأكثر وفرة في الكون.
لذلك أوضحنا كيف أن معظم حجم الذرة يشغل النواة، حيث تحدثنا عن الأجزاء المكونة للذرة وكيف تشكلت، بالإضافة إلى معلومات عامة عن الأجزاء المكونة للذرة والإلكترونات.