تؤدي زيادة درجة الحرارة إلى زيادة الضغط مع تغير الحجم. تجمع الفيزياء بين مفاهيم مختلفة لشرح معظم قوانين الفيزياء التي صممها العلماء الذين يشرحون الظواهر الطبيعية من حولنا وهناك علاقة بين الحرارة والضغط والحجم وهي مفاهيم تتعلق بشكل خاص بالغازات ذات الصلة وفي هذا الصدد موقع مقالتي سيوفر لنا هذا المقال للإجابة على سؤالنا ومعرفة المزيد عن القوانين المتعلقة بالغازات.
تؤدي الزيادة في الحرارة إلى زيادة الضغط مع تغير الحجم
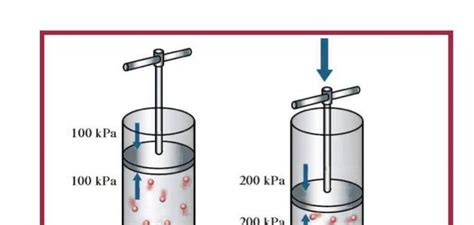
بين هذه المصطلحات (درجة الحرارة والضغط والحجم) هناك علاقة وثيقة توصل إليها العالم روبرت بويل وبموجب قانون سمي لاحقًا باسمه (قانون بويل) حدد تغير درجة الحرارة على أنه pv = p1، v1، ومن هذا يتبع العلاقة العكسية بين الضغط والحجم، وعندما تزداد درجة الحرارة يزداد الضغط ويتغير الحجم، فعندما يزداد الضغط ينقص الحجم والعكس صحيح، ومن هذا البيان التالي
- تؤدي زيادة درجة الحرارة إلى زيادة الضغط عندما يتغير الحجم، وهذا صحيح.
سلوك الغاز الحقيقي ينحرف عن سلوك الغاز المثالي عند ضغط منخفض ودرجة حرارة منخفضة
غاز مثالي

هو غاز افتراضي بمواصفات خاصة لا وجود له في الطبيعة، وهذه المواصفات تملي عدم وجود تفاعلات داخل جزيئات هذا الغاز، أو وجود تفاعلات بين جزيئات الغاز والجزيئات المحيطة بها، وبالتالي فهي نموذج غازي منخفض الكثافة ومثالي لإجراء تجارب العلوم الفيزيائية. اكتشف هذا. يعود تاريخ النموذج إلى القرن التاسع عشر وهو مطابق لوجود الغازات النبيلة مثل النيون والأرجون والهيليوم.
ما هي الغازات الأكثر شيوعًا في الغلاف الجوي
قانون الغاز المثالي

هناك قانون يسمى قانون الغاز العام يستخدم لحساب المفاهيم المختلفة المتعلقة بالغازات، مثل الضغط والحجم والشامات ودرجة الحرارة. هذا القانون هو pv = nRt، حيث[1]
- يتم قياس الضغط p بالضغط الجوي
- يقاس الحجم باللتر
- عدد المولات، n، يقاس بالمولات
- ثابت الغاز العام R ليس له أي قيمة، وقيمته 0.0821 atm / mol.Kelvin
- تُقاس درجة الحرارة t بالكلفن.
وها قد وصلنا إلى نهاية مقالنا، حيث تمت الإجابة على السؤال زيادة درجة الحرارة تؤدي إلى زيادة الضغط عندما يتغير الحجم، وهي عبارة صحيحة، ويتم التعرف على الغاز المثالي، وما هو قانون الغاز المثالي وما هي من رموزها.